
A preocupação com a constituição da matéria surgiu por volta do século V a.C., na Grécia.
O filósofo grego Empédocres, estabeleceu a “Teoria dos Quatro Elementos Imutáveis” onde acreditava que toda matéria era constituída por quatro elementos: água, terra, fogo e ar, que eram representados pelos seguintes símbolos:
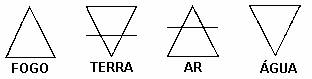
Esses 4 elementos básicos eram aliados às quatro qualidades: quente, frio, seco e úmido:
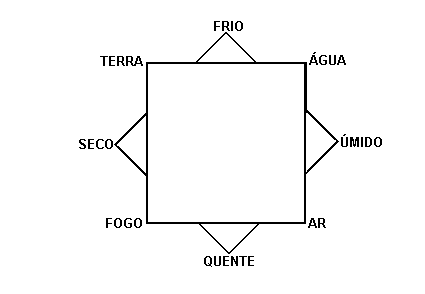
Tudo na natureza seria formado pela combinação desses quatro elementos, em diferentes proporções.
Leucipo de Mileto (aprox. 500 a.C) nos deu a primeira noção de átomo, partindo da própria semântica da palavra: ÁTOMO vem do grego "A-TOMOS" e significa INDIVISÍVEL. Ele acreditava também que o vácuo não existia somente no mundo em que vivemos, mas muito além, no infinito espaço do cosmos. Achava, ainda, que existia um número infinito de mundos, todos compostos de um número infinito de átomos.
Demócrito de Abdera (aprox. 460 a.C), discípulo de Leucipo, explicou que a matéria era constituída de partículas em pérpetuo movimento e dotadas das seguintes qualidades: indivisibilidade, invisibilidade (pelo seu tamanho extremamente pequeno), solidez, eternidade (por ser perfeita, segundo ele), cercada por espaços vazios (o que explicava o seu movimento e diferentes densidades) e dotada de um infinito número de formas (explicando a diversidade na natureza).
Com isso, os filósofos gregos Leucipo e Demócrito desenvolveram a seguinte idéia filosófica: no universo há duas coisas, os átomos e o vácuo, o mundo é, portanto, composto de montes de matéria em um mar de vazio total. Os átomos são substâncias sólidas, infinitos em número e forma e, a maioria deles, se não todos, muito pequenos para serem vistos. Um átomo não poderia ser cortado ou dividido de qualquer maneira, e é completamente sólido. Todos os átomos estão em perpétuo movimento no vácuo.
Especula-se que o "nascimento" do conceito de átomo não ocorrera na Grécia, como normalmente aprendemos, mas sim, na Índia, com a filosofia Vaiseshika, a qual já falava que a matéria era formada de átomos indestrutíveis. A matéria, para os indianos, seria composta de partículas invisíveis e poderia ser degradada (no final dos tempos), quando os "laços" entre um átomo e o outro iriam se romper. Aí, então, eles se reorganizariam em um novo mundo. Consideravam a idéia de partícula e anti-partícula, as entidades da vida, que formavam ocompleto e todos os tipos de incompleto. Juntos, formariam o conhecimento pleno (yin - yang)
Em 1808, John Dalton a partir da idéia filosófica de átomo estabelecida por Leucipo e Demócrito, realizou experimentos fundamentados nas Leis Ponderais, propôs uma Teoria Atômica, também conhecido como modelo da bola de bilhar, a qual expressa, de um modo geral, o seguinte:
O átomo é constituído de partículas esféricas, maciças, indestrutíveis e indivisíveis. | |
A combinação de átomos de elementos diferentes, numa proporção de números inteiros, origina substâncias químicas diferentes. | |
Numa transformação química, os átomos não são criados nem destruídos: são simplesmente rearranjados, originando novas substâncias químicas. | |
Elementos químicos diferentes apresentam átomos com massas, formas e tamanhos diferentes. | |
Um conjunto de átomos com as mesmas massas, formas e tamanhos apresenta as mesmas propriedades e constitui umelemento químico. |
Na época de Dalton haviam sido isolados apenas 36 elementos químicos e ainda se utilizavam símbolos vindos da alquimia para representar tais elementos. O próprio Dalton foi autor de uma destas simbologias. Veja a ilustração a seguir adaptada de um de seus livros:

Os símbolos de Dalton não eram muito diferentes dos símbolos mais antigos da alquimia, porém traziam uma inovação. Cada átomo possuía um símbolo próprio e a fórmula de um composto era representada pela combinação destes símbolos. Veja os exemplos:
A nomenclatura utilizada por Dalton, que é basicamente a mesma utilizada até hoje, foi introduzida pelo Francês Antoine Lavoisier, em 1787, no livro Methods of Chemical Nomenclature. Antes de ser decapitado, em 1794 na revolução francesa, entre outras coisas, Lavoisier escreveu o livro Reflexions sur le Phlogistique (1783), que terminou com a teoria do flogistico e também escreveu o livro Traité Élémentaire de Chimie, em 1789, que é considerado como o primeiro livro da Químicamoderna.
O uso de símbolos abstratos só terminou por volta de 1813-1814, com Berzelius, que, além de ter isolado o cálcio, bário, estrôncio, silício, titânio e o zircônio, também descobriu o selênio, o tório e o césio. Quando Berzelius decidiu que era hora de mudar as coisas ele realmente mudou. Tendo em vista que os símbolos antigos não eram fáceis de escrever, desfiguravam os livros e não colaboravam em nada para a sua memorização, Berzelius propôs que os símbolos fossem representados por letras, baseadas na letra inicial do nome em Latim de cada substância elementar.
Com algumas alterações, os símbolos dos elementos continuam os mesmos até hoje. Por exemplo, Oxigênio = O, Chumbo = Pb....
Tubos de raios catódicos
Com o aparecimento das ampolas de Crookes (tubos especiais com as quais consegue-se reduzir a pressão interna até 10-9atm) em 1897, J. J. Thomson dedicou-se a pesquisar a natureza dos raios catódicos (feixe que sai do cátodo), concluindo que:
1) Os raios catódicos são corpusculares, pois quando interceptam um molinete de mica, este entra em rotação:
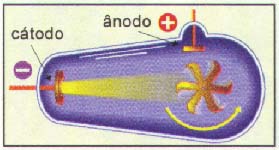
2) Os raios são constituídos de partículas com carga elétrica, pois são desviados por um campo elétrico e magnético e, pelo sentido do desvio, as partículas são negativas sendo denominadas de elétrons:
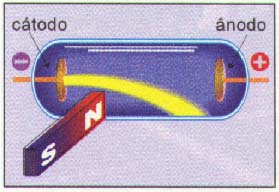
3) Pela medida do desvio dos raios catódicos sob ação de um campo magnético, ele pode determinar a relação e/m entre a carga do elétron (e) e sua massa (m).
No final do século XIX (1874), Joseph John Thomson, através de experimentos de descargas elétricas em alto vácuo, sugeriu um modelo de átomo em que o átomo fosse maciço, esférico, descontínuo, formado por um fluido com carga elétrica positiva, no qual estariam dispersos os elétrons com carga negativa, que neutralizam totalmente as cargas positivas do fluido. O próprio Thomson associou o seu modelo a um “pudim de passas”.
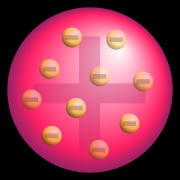
Modelo atômico do pudim de passas
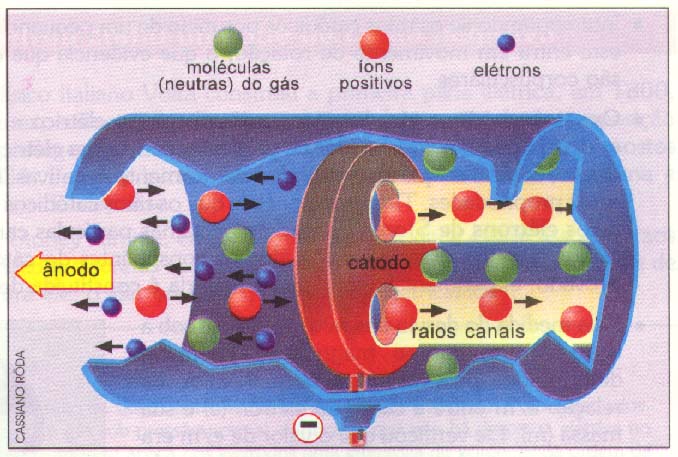
Em 1886, Goldstein obteve os raios canais, que se propagam em sentido oposto ao dos raios catódicos. Experiências posteriores mostram que:
1) Os raios canais são constituídos por partículas positivas denominadas prótons;
2) A massa das partículas constituintes dos raios canais é aproximadamente igual à massa das moléculas do gás residual (gás contido no interior da ampola de Goldstein);
3) Quando o gás residual é o hidrogênio, a massa das partículas dos raios canais é a menor e aproximadamente 1836 vezes maior que a massa do elétron, e a carga dessas partículas é igual à do elétron, com sinal contrário.
Em 1911, Ernest Rutherford, cientista nascido na Nova Zelândia, realizou um experimento, para comprovar o modelo proposto atômico por Thomson, que consistiu em bombardear uma fina folha de ouro (0,0001 cm) com partículas positivas e pesadas, denominadas partículas alfa (α), emitidas por um elemento radioativo chamado polônio.
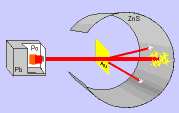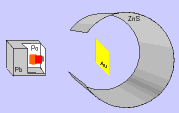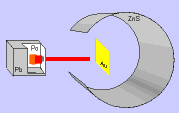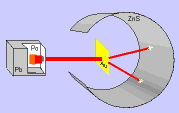
Durante a realização da experiência, Rutherford observou que:
a) a maioria das partículas α atravessaram a folha de ouro sem sofrer desvios e sem alterar a superfície da folha de ouro.
b) algumas partículas α sofreram desvios ao atravessar a folha de ouro.
c) muito poucas partículas α não atravessaram a folha de ouro e voltaram.
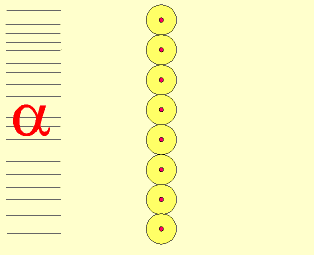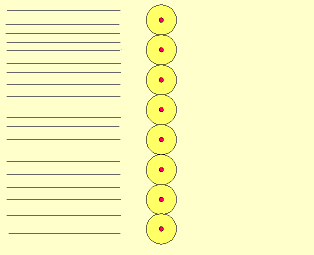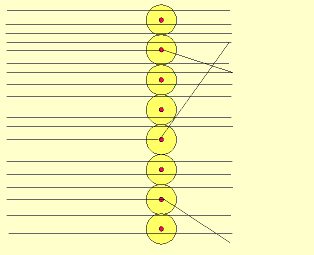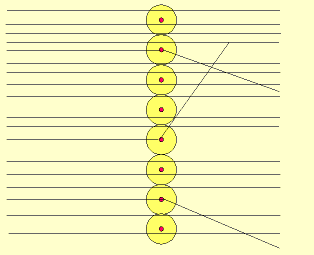
Em função dos resultados obtidos, Rutherford concluiu que:
1- como a maioria das partículas α atravessaram a folha de ouro sem sofrer desvios, pode-se concluir que o átomo é descontínuo, ou seja, predominam grandes espaços vazios denominados eletrosfera onde estariam localizados os elétrons.
2- como algumas partículas α sofreram desvios ao atravessar a folha de ouro, pode-se concluir que o átomo é constituído por uma pequena região maciça, denominada de núcleo, onde estaria concentrada a massa do átomo.
3- como muito poucas partículas α, carregadas positivamente, não atravessaram a folha de ouro, sabendo-se que cargas de mesmo sinal se repelem, pode-se concluir que o núcleo do átomo é positivo.
4- a contagem do número de partículas que atravessam e que sofreram desvio permite fazer uma estimativa de que o raio de átomo de ouro (núcleo + elestrofera) é da ordem de 10 mil a 100 mil vezes maior do que o seu próprio núcleo. Por efeito de comparação, podemos imaginar se o núcleo atômico como sendo uma formiga, o átomo teria a dimensões comparáveis á extensão do maracanã.
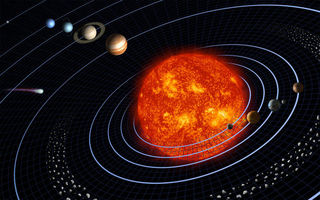
Modelo atômico semelhante ao sistema solar: elétrons em orbitas circulares na eletrosfera
O experimento da folha de ouro, permitiu a criação de um modelo atômico semelhante ao Sistema Solar, onde o átomo seria constituído de duas regiões distintas:
I) Um núcleo, pequeno e positivo, que contém praticamente toda a massa do átomo.
II) Uma região negativa, praticamente sem massa, que envolve o núcleo, apresentando carga negativa, denominadoeletrosfera.

ILUSTRAÇÃO DO MODELO ATÔMICO PLANETÁRIO DE RUTHERFORD.
Em 1900, Max Planck, físico alemão, descobriu que átomos ou moléculas absorviam ou emitiam energia apenas em quantidades discretas, ou seja, em parcelas pequenas e muito bem definidas. Definiu o conceito de QUANTUM como sendo a quantidade de energia que pode ser emitida ou absorvida na forma de radiação eletromagnética. Acabara de conceber a idéia de energia DESCONTíNUA, ou quantizada. Albert Einstein, em 1905, chamou os quanta de Planck de photons (fótons) e estabeleceu, ainda, que energia tem massa.
NOTA: A importância de se ter uma noção de energia quantizada é utilizada para compreendermos o próximo avanço no estudo do átomo: o Modelo Atômico de Böhr. Lembrar, então, que a energia é descontínua ( idéia depacotinhos de energia ).
Niels Henrik David Bohr
Em 1913, Niels Böhr, por meio de pesquisas e análise das teorias da época, como a do efeito Zeeman, do efeito fotoelétrico, das séries espectrais dos elementos químicos e, principalmente, a teoria de Planck, Böhr percebeu que deveria haver alguma relação entre as energias dos elétrons em suas órbitas atômicas e as correspondentes freqüências, conforme sugeria a teoria da radiação de Max Planck.
Por que a luz comum forma o arco-íris ao passar por uma nuvem? Por que certos átomos quando aquecidos, emitem luz de uma só cor, como acontece com as “lâmpadas de sódio” (luz amarela) existentes em nossas estradas?
Böhr propôs a seguinte explicação para estes fenômenos:
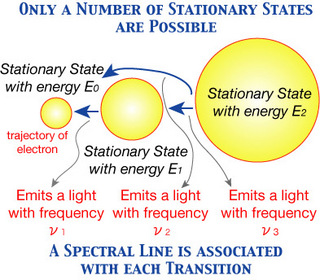
“Os elétrons giram ao redor do núcleo em um número limitado de órbitas bem definidas, que são denominadas de órbitas estacionárias, com determinados níveis de energia.
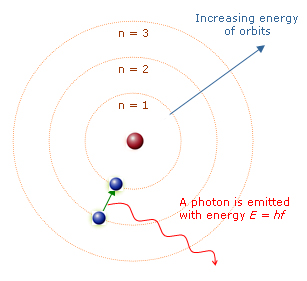
Quando um elétron absorve uma determinada quantidade de energia do exterior (luz, calor ou eletricidade) ele salta para uma órbita (nível) mais energética (estado excitado).
Salto do elétron
Ao retornar para a órbita original, o elétron perde energia na forma de ondas eletromagnéticas (luz de cor bem definida).
Retorno do elétron
Esses saltos se repetem milhões de vezes por segundo, produzindo assim uma onda eletromagnética, que nada mais é do que uma sucessão de ondas emitidas.
POSTULADOS DE BÖHR
- A energia radiada não é emitida ou absorvida de maneira contínua, somente quando um elétron passa de uma órbita estacionária para outra diferente ( salto quântico ).
- Os elétrons giram em torno do núcleo em órbitas circulares e bem definidas (fixas) que são as órbitas estacionárias. Mais tarde, seriam as chamadas "camadas eletrônicas" (K,L,M,N,O,P e Q).
- O equilíbrio dinâmico dos sistemas nos estados estacionários se dá pelas leis da mecânica clássica, o que não é verificado quando um elétron passa para um diferente estado estacionário.
- Ao passar de um estado estacionário para outro, um elétron absorve uma radiação bem definida, que é o quantum, dado pela relação E = h.v , onde v é a freqüência e h é a constante de Planck.
Simplificando, observamos que:
| quando um elétron RECEBE energia, ele salta para uma órbita MAIS EXTERNA. A quantidade de energia absorvida é bem definida ( quantum ) e equivale à diferença energética entre as camadas. | |
| quando um elétron volta para o seu estado estacionário (órbita mais interna), ele LIBERA ou IRRADIA energia sob a forma de raio X, ultravioleta ou luz, que seria o fóton. Essa energia também é muito bem definida ( quantum ). | |
| Cuidado com os conceitos de ELÉTRON ESTACIONÁRIO ( girando em sua órbita normal, em seu estado estacionário ) e ELÉTRON ATIVADO ou EXCITADO ( aquele que saltou para um nível mais externo pela absorção de energia ). |
APLICAÇÕES DO MODELO DE BOHR
-Teste da chama
Teste da chama com CuSO4: uma das mais importantes propriedades dos elétrons é que suas energias são "quantizadas",ou seja, um elétron ocupa sempre um nível energético bem definido e não um valor qualquer de energia. Se no entanto um elétron for submetido a um fonte de enrgia adequada (calor, luz, etc.), pode sofrer uma mudança de um nível mais baixo para outro de energia mais alto (excitação). O estado excitado é um estado meta-estável (de curtíssima duração) e, portanto, o elétron retorna imediatamente ao seu estado fundamental. A energia ganha durante a excitação é então emitida na forma de radiação visível do espectro eletromagnético que o olho humano é capaz de detectar ou não. Como o elemento emite uma radiação característica, ela pode ser usada como método analítico
-Fogos de artificio
FOGOS DE ARTIFÍCIO: Os fogos de artifício modernos empregam perclorato, substâncias orgânicas como amido ou açúcar, produtos do petróleo e pequenas quantidades de metais para dar cor. O funcionamento fundamenta-se na excitação dos elétrons que, ao retornarem a sua órbita original, emitem luz com cores diferentes. Aqui, uma exibição de fogos de artifício na cidade de Nova York.
-Luminosos e lâmpadas (neônio e lâmpadas de vapor de Na ou Hg)
LUMINOSOS: A imagem mostra como brilham as luzes de néon na noite de Las Vegas (EUA). As lâmpadas de néon são usadas na arte, na publicidade e até em balizas de aviação. Para fabricá-las, enche-se com gás néon, a baixa pressão, tubos de vidro dos quais todo o ar foi retirado. Ao aplicar eletricidade, uma corrente flui através do gás entre os dois eletrodos fechados dentro do tubo. O néon forma uma banda luminosa entre os dois eletrodos. (Neônio – luz vermelha, Argônio – luz azul, Neônio + gás carbônico – luz violeta).
-Fluorescência e Fosforescência: Luminescência é a emissão de luz causada por certos materiais que absorvem energia e podem emiti-la em forma de luz visível. Se o intervalo entre absorção e emissão é curto (ocorre imediatamente), o processo se denomina fluorescência; quando o intervalo é longo (ocorre em alguns segundos ou algumas horas),fosforescência. As telas das televisões são recobertas por materiais fluorescentes, que brilham ao serem estimulados por um raio catódico. A fotoluminescência se produz quando determinados materiais são irradiados com luz visível ou ultravioleta.
Fluorescência se define como as propriedades das substâncias de adquirirem luminescência ao serem submetidas aos raios ultravioletas, ou seja, quando são iluminadas.

O melhor exemplo prático da aplicação da fluorescência é a sinalização de trânsito, você já reparou que nas rodovias existem placas que se iluminam quando os faróis do carro vão de encontro a elas. Este efeito permite visualizarmos o que está escrito nas placas, imagine se não existisse esta propriedade? Como as placas seriam lidas à noite? Mas quais substâncias são responsáveis por este fenômeno químico? O Tetracianoplatinato de Bário e Sulfeto de Zinco (ZnS). A excitação dos elétrons produz energia capaz de gerar luz.
Os interruptores feitos com material fosforescente são visíveis no escuro graças ao retorno gradual dos elétrons excitados.

Fosforescência é observada quando uma substância possui luminescência própria, por exemplo, os mostradores de relógio
-Raio Laser

O raio laser é um tipo de radiação eletromagnética visível ao olho humano. O laser hoje é muito aplicado como, por exemplo, nas cirurgias médicas, em pesquisas científicas, na holografia, nos leitores de CD e DVD como também no laser pointer utilizado para apresentação de slides. Na indústria o laser de dióxido de carbono tem sido muito utilizado, pois possibilita um processo rápido de corte e solda de materiais
-Bioluminescência: a luz dos vaga-lumes.
O vaga-lume é um inseto coleóptero que possui emissões luminosas devido aos órgãos fosforescentes localizados na parte inferior do abdômen. Essas emissões luminosas são chamadas de bioluminescência e acontecem devido a reações químicas onde a luciferina é oxidada pelo oxigênio nuclear produzindo oxiluciferina que perde energia fazendo com que o inseto emita luz. Na reação química, cerca de 95% aproximadamente da energia produzida transforma-se em luz e somente 5% aproximadamente se transforma em calor. O tecido que emite a luz é ligado na traquéia e no cérebro dando ao inseto total controle sobre sua luz.
ELETROSFERA
As idéias estabelecidas por Böhr contribuíram para estabelecer que no moderno modelo atômico, os elétrons devem se distribuir na eletrosfera do átomo em determinados níveis de energia (n), sendo conhecidos atualmente 7 níveis de energia (n = 1, 2, 3, 4, 5, 6, 7) ou, ainda, 7 camadas eletrônicas (K, L, M, N, O, P, Q).
Em cada camada ou nível de energia existe um número máximo de elétrons determinado experimentalmente.
A seguir temos os níveis (camadas) e o número máximo de elétrons permitidos para os atuais elementos:
Camada | Nível de energia (n) | Número máximo de elétrons |
K | 1 | 2 |
L | 2 | 8 |
M | 3 | 18 |
N | 4 | 32 |
O | 5 | 32 |
P | 6 | 18 |
Q | 7 | 8 |

James Chadwick
Em 1932, o físico inglês James Chadwick constatou que os núcleos dos átomos, assim como as próprias partículas alfa, continham em sua estrutura, além dos prótons que lhes conferiam carga positiva, outras partículas, de carga elétrica neutra e massa aproximadamente igual à do próton, que evitam a repulsão dos prótons, denominadas de nêutrons. (leia mais sobre a descoberta do nêutron).
O físico alemão Arnold Johannes Wilhelm Sommerfeld em 1916 apresentou um novo modelo atômico baseado na mecânica quântica, sobre o qual afirmava que os elétrons descreviam órbitas circulas e ELÍPTICAS ao redor do núcleo. Considerou, ainda, que a energia liberada como fóton era pelo fato de as camadas eletrônicas possuírem certas subdivisões, os subníveis energéticos - s, p, d, f. Para ele, uma órbita era circular (s) e as demais, elípticas.
Utilizando a Teoria da Relatividade Restrita, Sommerfeld foi capaz de explicar o desdobramento da série clássica de Balmer relativa ao átomo de Hidrogênio.
A série de Balmer corresponde às transições entre o nível 2 e os níveis 3,4,5...
O físico austríaco Erwin Schrödinger (1887-1961) foi o primeiro a introduzir o conceito de ORBITAL como sendo uma região de máxima probabilidade de encontrarmos um elétron, baseado nas teorias de Einstein, Planck e De Broglie.
O orbital s possui forma esférica ...................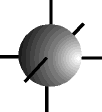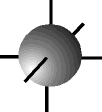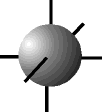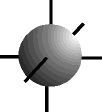
e os orbitais p possuem forma de halteres. ............
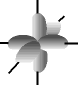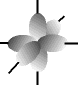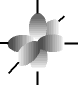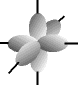


O francês Louis de Broglie (1892-1987) foi o primeiro cientista a falar sobre mecânica ondulatória e admitir o comportamento dual do elétron, ora partícula, ora onda, em um movimento contínuo, o que o caracteriza como partícula-onda. Modernamente, aceita-se esse modelo. O elétron apresenta caráter duo por apresentar massa (partícula) e movimento ondulatório na eletrosfera (onda).
Segundo o Princípio da Incerteza do alemão Heisenberg (1901-1976), não se pode conhecer com precisão absoluta a posição ou o momento (e, portanto, a velocidade) de uma partícula. Isto acontece porque para medir qualquer um desses valores acabamos os alterando, e isto não é uma questão de medição, mas sim de física quântica e da natureza das partículas.
O princípio da incerteza é equacionado através da fórmula:

No seu nível mais fundamental, o princípio da incerteza é uma conseqüência da dualidade partícula-onda e do princípio de Broglie. Se uma partícula encontra-se em uma região com erro ∆x, então seu comprimento de onda natural deve ser menor que ∆x, o que requer um momento elevado, variando entre -h/Δx e h/Δx. Aí está a incerteza! O raciocínio é análogo para a indeterminação do momento.
O princípio de exclusão de Pauli é um princípio da mecânica quântica formulado por Wolfgang Pauli em 1925. Ele afirma que dois férmions idênticos não podem ocupar o mesmo estado quântico simultaneamente. Uma forma mais rigorosa de enunciar este princípio é dizer que a função de onda total de um sistema composto por dois fermions idênticos deve ser anti-simétrica. Para elétrons de um mesmo átomo, ele implica em que dois elétrons não podem ter os mesmos quatro números quânticos. Por exemplo, se os números quânticos n, l, e ml são iguais nos dois elétrons, estes deverão necessariamente ter os números msdiferentes, e portanto os dois elétrons têm spins opostos.
SAIBA MAIS SOBRE....
TRITURADORES DE ÁTOMOS
O nome próprio é portentoso: Grande Colisor Elétron-Pósitron. O nome de família não é menos respeitável: superacelerador de partículas. Trata-se do maior instrumento de pesquisa do mundo. Serve para estudar a vida íntima do átomo e a origem do Cosmo.
Cerca de 100 metros abaixo do solo, na periferia da cidade de Genebra, na Suíça, funciona o maior complexo científico já construído no planeta. Na superfície, a paisagem da região de fronteira com a França é de um sossegado cartão-postal de outros tempos: pequenos bosques, pastagens e a cordilheira do Jura, que separa os dois países. Mas, ao tomar num dos oito pontos de acesso construídos no campo o que em circunstâncias normais seria apropriadamente chamado elevador, o visitante mergulha de repente num mundo de vertigem - uma espécie de catedral subterrânea feita de aço e governada por dispositivos eletrônicos. São os controladores do LEP, iniciais em inglês de Grande (Colisor) Elétron-Pósitron, um túnel em formato de anel de 27 quilômetros de circunferência e 7 metros de diâmetro.
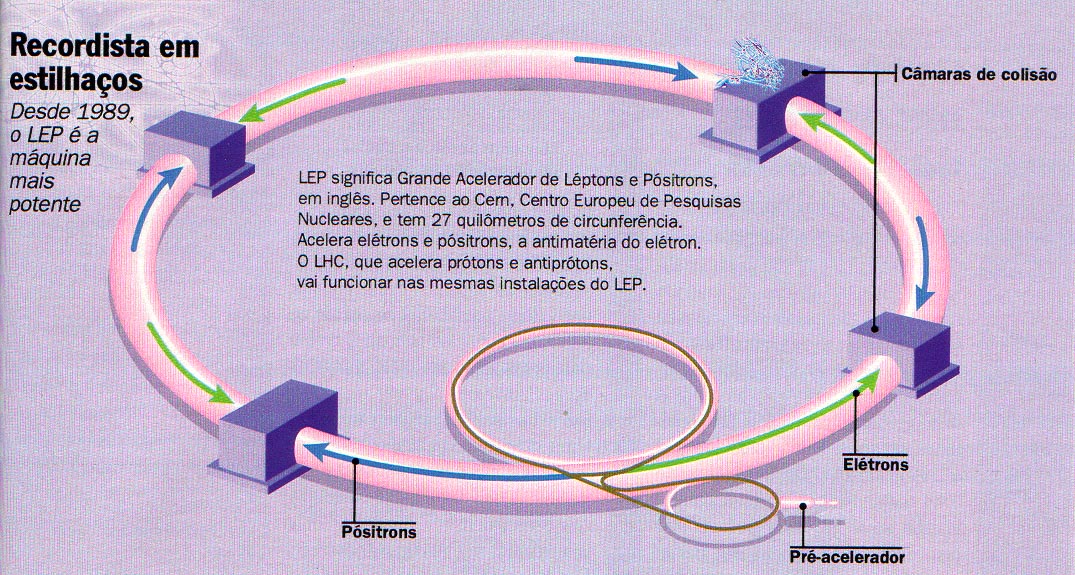
Acelerador de partículas.
Trata-se da jóia da coroa de um dos mais renomados estabelecimentos de pesquisa do século, o CERN, sigla que originalmente designava em francês o Centro Europeu de Investigações Nucleares, depois rebatizado Laboratório Europeu de Física de Partículas, exemplo de bem-sucedida colaboração internacional em ciência. Inaugurado há apenas quatro meses, o LEP nasceu para ajudar a conhecer mais de perto algumas das frações ínfimas de matéria do Universo. É um paradoxo: para devassar essas partículas que não medem mais de 1 bilionésimo de milésimo de milímetro, os físicos europeus tiveram de construir uma estrutura gigantesca.
A instalação pode ser comparada a um autódromo, por onde os elétrons, componentes dos átomos com carga elétrica negativa, se precipitam em desvairada corrida. Em sentido contrário precipitam-se as antipartículas pósitrons - elétrons com carga positiva. Nesse proposital curso de colisão, milhares e milhares de partículas e antipartículas, deslocando-se quase à velocidade da luz, acabam por se aniquilar mutuamente, liberando energia equivalente à fissão de quinhentos núcleos de átomos de urânio. Mas esse é apenas um valor teórico: não se trata ali de experiências atômicas, ao menos no sentido comum da expressão. O que os físicos pretendem com os choques que planejaram é servir-se depois de uma salada de partículas básicas, coisa ainda menor que o elétron e que sua imagem espelhada, o pósitron.
De fato, com a ajuda dos aceleradores se descobriu que tudo o que existe - rigorosamente tudo - é feito apenas de três famílias de partículas elementares indivisíveis: quarks, léptons e bósons. Os quarks fazem os nêutrons e prótons no núcleo dos átomos. Os léptons fazem os elétrons, entre outras coisas. Os bósons formam uma classe especial de partículas mensageiras, responsáveis pelas interações entre as outras famílias.
Essas mensageiras ajudam grupos de quarks e outros de léptons a se combinar com as quatro forças básicas que regem o Universo, criando todos os corpos compostos. Tais forças, como se sabe, são a gravitacional, o eletromagnetismo e as interações forte (responsável pela coesão do núcleo atômico) e fraca (que rege os fenômenos da radioatividade). Desde Einstein, na década de 30, os físicos acreditam que essas forças são manifestações de uma força única que agiu somente nos instantes que se seguiram ao Big Bang, a explosão que teria originado o Universo.
A descoberta do elétron inaugurou a era das partículas elementares. Depois de 100 anos de pesquisa, conhecemos cerca de 10 diferentes partículas elementares e temos um modelo, como Modelo Padrão, que descreve com extraordinária precisão o comportamento dessas partículas.
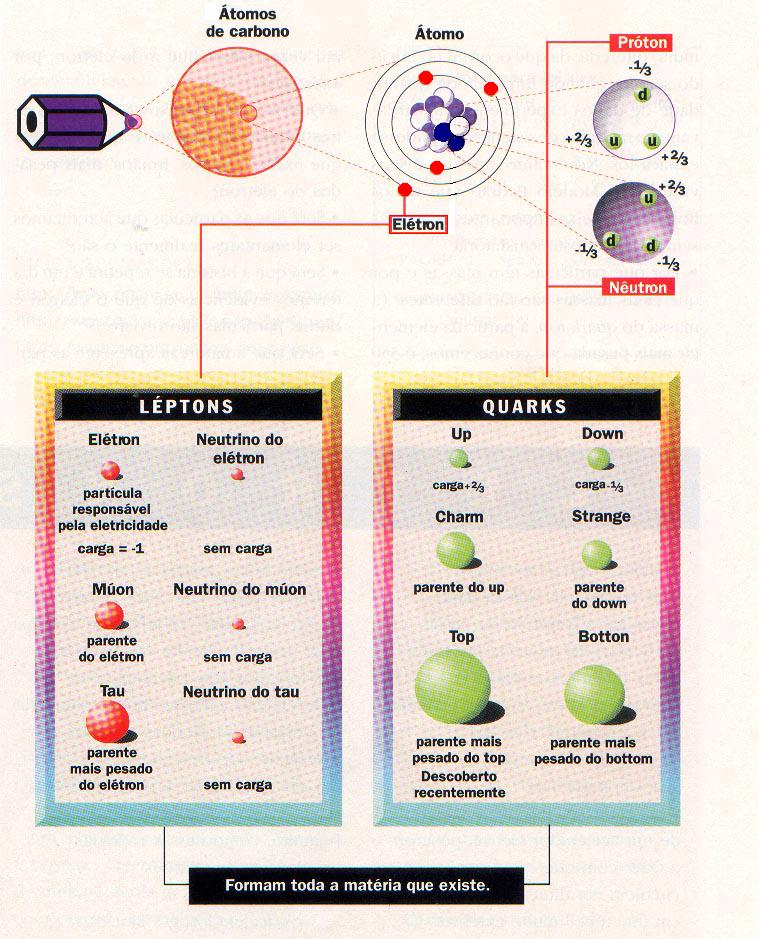
Famílias das partículas elementares, segundo o chamado Modelo Padrão.
Os quarks são considerados as partículas fundamentais da matéria porque constituem os prótons e os nêutrons, o núcleo do átomo. Mas, fora do núcleo, existe outra família de partículas — a dos léptons
A família dos quarks:
Existem seis. Mas apenas dois, o up e o down, conseguem se manter inteiros na natureza, hoje. Os outros precisam de muito mais energia para sobreviver. Parece esquisito, mas todos eles têm carga elétrica de (- 1/3) ou (+ 2/3)
Up(pra cima)
O menor dos quarks tem um longo tempo de vida. Cada próton possui dois ups e cada nêutron, um
Charm (charmoso)
Só é criado dentro dos aceleradores e tem um tempo de vida brevíssimo: 10 -13 segundos
Top (topo)
O mais obeso dos quarks equivale a 237 quarks up e down. Vive apenas 10 -23 segundos
Down (pra baixo)
É o irmão do up e também parte fundamental da matéria. Cada próton tem um down e cada nêutron, dois
Strange (estranho)
O irmão do charm também não existe mais. Sobrevive muito pouco tempo nos aceleradores
Bottom (fundo)
Pesado demais para sobreviver no Universo de hoje. Nos aceleradores, dura só10 -13segundos
Os léptons são partículas constituintes da eletrosfera que participam na interação eletromagnética e na interação fraca.
A família dos léptons:
O pai-de-todos, o elétron, tem duas versões mais pesadas: o muon e o tau — todos com carga elétrica de (+1) ou (–1). Seus irmãos neutrinos são partículas mais exóticas: não possuem carga elétrica e não se sabe ainda se têm massa
Elétron
Presente em toda matéria comum, é responsável pela eletricidade e pelas reações químicas
Múon
Primo mais pesado do elétron, sobrevive nos aceleradores apenas dois milionésimos de segundo
Tau
O mais pesado de todos os léptons sobrevive por um período de tempo curtíssimo
Elétron neutrino
Possivelmente não tem nenhuma massa. A cada segundo, bilhões dessas partículas atravessam nosso corpo
Múon neutrino
Surge sempre junto com o múon, só nos raios cósmicos ou nos aceleradores de partículas
Tau neutrino
O irmão mais magro do tau ainda não foi descoberto, mas a teoria garante que ele existe
Os Bósons são partículas mediadoras entre os quarks e léptons, que transmitem as forças da natureza.

Partículas de matéria que transmitem forças.
A família dos Bósons:
Grávitons: transmitem a força da gravidade.
Glúons: carregam a força forte que mantém os quarks juntos.
Fótons: partículas quânticas de luz, transmitem a força eletromagnética entre os elétrons e o núcleo atômico.
Bósons vetores: transmitem força entre os nêutrons e prótons no núcleo atômico.
Podemos concluir que a matéria é constituída por pequenos núcleos, altamente densos onde concentra-se a massa do átomo, carregados positivamente, constituídos de prótons (p) e nêutrons (n), cercados por regiões praticamente vazias denominadas de eletrosfera, onde encontram-se os elétrons (e), de carga negativa.
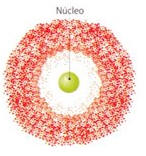
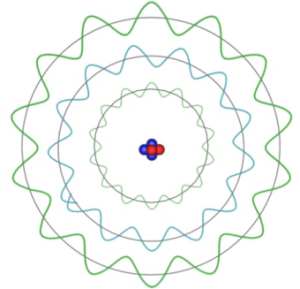
Modelo atômico da nuvem eletrônica
Os cientistas abandonaram a idéia de que o elétron descrevia uma trajetória definida em torno do núcleo e passaram a admitir que existem zonas onde há maior probabilidade de encontrar os elétrons, designadas por orbitais.
Visite também..












Caros amigos, super bacana este artigo!
ResponderExcluirPara mim o equilíbrio e harmonia da matéria, energia, tempo e espaço, estao interligados as condições de campo energetico disponíveis, ou seja, tudo entra em equilíbrio dependendo da condição energética.
Por exemplo, se o elétron diminuir sua frequencia e velocidade esta energia será lançada ao futuro, bem como, se o elétron estiver em uma
Se alguém tiver interesse de discutir um pouco sobre tempo espaço, buracos negros, me ligue 47 99667104 ou email charlesadrianoduvoisin@gmail.com
ResponderExcluirÓtimas energias a todos.